الجيل القادم من علاجات سرطان الدم
الجيل القادم من علاجات سرطان الدم
طفرة نوعية لتحسين فرص النجاة
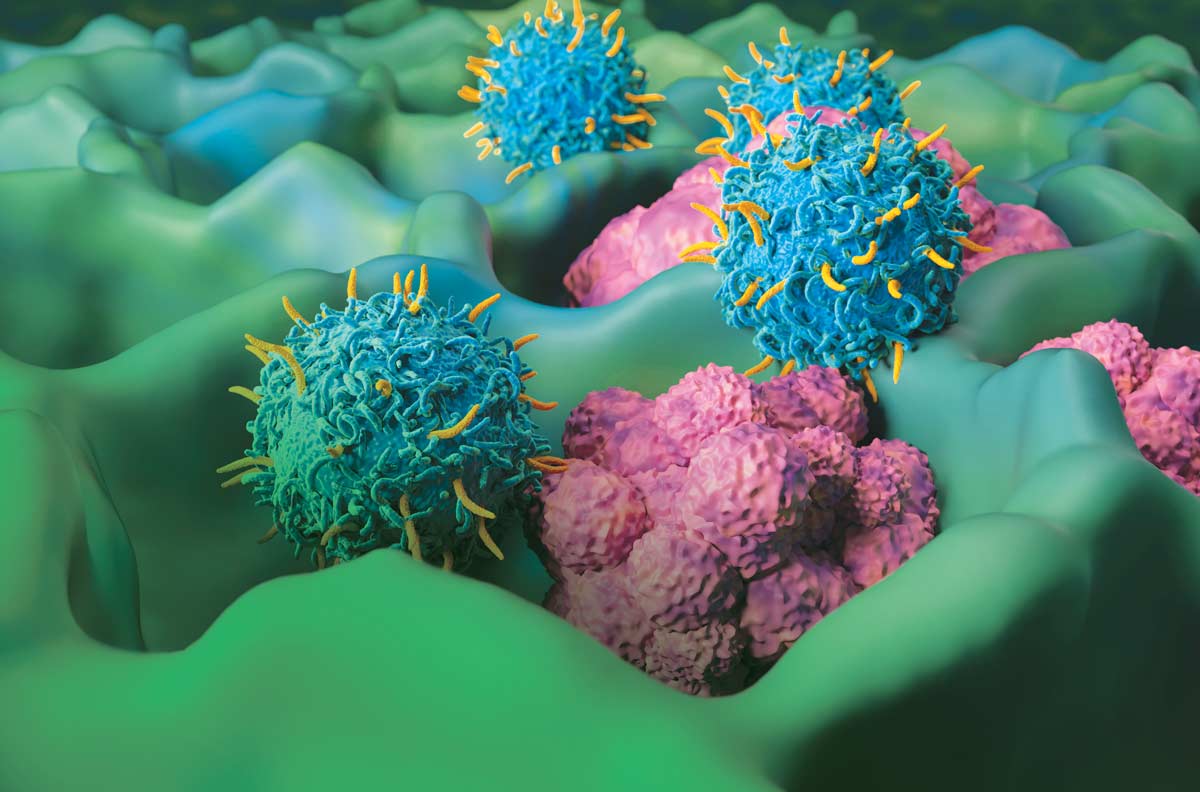
حقق سرطان الدم طفرة نوعية، حيث شهدت أساليب العلاج والتشخيص تقدمًا هائلاً، وهو ما يعزّز بشكل جذري فرص نجاة المرضى فضلًا عن تحسين جودة حياتهم بمستويات لم تكن متوقعة سابقًا. تشهد هذه العلاجات ثورة حقيقية في طب الأورام الدموية. فبعد عقود من الاعتماد على العلاج الكيميائي والإشعاعي، أصبح التركيز الآن منصباً على العلاج الموجه (Targeted Therapy) والعلاج المناعي (Immunotherapy) الذي يعمل بذكاء بالغ.
لم يعد الهدف هو تدمير الخلايا السريعة النمو عشوائياً، بل أصبح تحديد الخلل الجزيئي أو البروتين الشاذ الذي يغذي السرطان، ومن ثم تصميم علاج قادر على إيقافه بدقة متناهية، أو ببساطة، تسخير القوة الهائلة للجهاز المناعي للمريض نفسه وتوجيهها نحو الخلايا الخبيثة. لقد أسهمت هذه التطورات في تحسين معدلات البقاء على قيد الحياة بشكل كبير وتحويل بعض أنواع سرطان الدم من أمراض مهددة للحياة إلى حالات مزمنة يمكن إدارتها، ما يمثل أملًا جديداً لمرضى سرطانات الدم.
العلاج بالخلايا التائية CAR T-cell therapy
يشهد مجال علاج الخلايا التائية ذات المستقبلات الكيميرية (Chimeric Antigen Receptor T-cell therapy) تحولاً جذريًا، حيث يمثل الجيل الثاني منه قفزة نوعية نحو علاج أكثر أمانًا وفاعلية. كان التحدي الأكبر سابقًا هو متلازمة إطلاق السيتوكينات والمضاعفات الخطيرة، لكن التقنية الجديدة تغلّبت على ذلك من خلال تصميم مستقبلات للتقليل من الاستجابة المناعية المفرطة.
هذا التعديل أدى إلى خفض كبير في الأعراض الجانبية الشديدة، جاعلاً العلاج أكثر تحملاً للمرضى. لم يقتصر التطور على الأمان، بل شمل أيضًا تحسين عملية التصنيع بشكل كبير، مما قلل الوقت اللازم لتجهيز الخلايا وإعادتها للمريض.
يرتكز هذا العلاج على تسخير قوة الجهاز المناعي للمريض نفسه؛ فتبدأ العملية بجمع الخلايا التائية من دم المريض، ثم تُرسل إلى المختبر حيث تُعدّل وراثياً لإضافة مستقبلات اصطناعية تسمى المستقبلات الكيميرية (CAR). تُمنَح هذه المستقبلات الخلايا التائية القدرة على التعرف بدقة على مستضدات معينة، مثل CD19 أوCD20، الموجودة على سطح الخلايا السرطانية. بعد تكاثرها بأعداد هائلة، تُعاد هذه الخلايا “المُدرّبة” إلى جسم المريض، لتبدأ مهمتها بالبحث عن الخلايا السرطانية وتدميرها بكفاءة عالية. لقد أثبت هذا النهج فعاليته في علاج حالات مثل سرطان الدم الليمفاوي الحاد (ALL)، وبعض أنواع الليمفوما كـ (Diffuse Large B-cell Lymphoma) و(Mantle Cell Lymphoma) و(Follicular Lymphoma). ومع أهميته، يظل علاجًا متخصصًا يتطلب تقييماً دقيقاً ومراقبة مستمرة من قبل فريق طبي متخصص. الأثر الأهم لهذا التطور هو فتح آفاق علاجية جديدة، خاصة للمرضى الذين يعانون من سرطانات الدم المقاوِمة، مثل بعض أنواع اللوكيميا والليمفوما التي لم تستجب للعلاجات التقليدية.
الأجسام المضادة ثنائية التخصص (Bispecific Antibodies)
تُعد الأجسام المضادة ثنائية التخصص (Bispecific Antibodies) إحدى أحدث الإنجازات الطبية، حيث أحدثت ثورة في استراتيجيات مكافحة سرطان الدم. تعمل هذه الجزيئات كـجسر موجه، إذ إنها تمتلك القدرة الفريدة على ربط الخلايا التائية المناعية مباشرة بـالخلايا السرطانية في آن واحد.
بفضل هذه الآلية المزدوجة، يتم توجيه الجهاز المناعي بدقة متناهية لتدمير الهدف السرطاني، ما يضمن فاعلية قصوى في القضاء على الخلايا المريضة مع تقليل الضرر على الأنسجة السليمة.
تتميز هذه الأجسام بقدرتها الهندسية الفائقة على التعرف على مستهدفين مختلفين والارتباط بهما في آن واحد، ما يطلق آلية مناعية فعالة ومُوجّهة بدقة. تكمن القوة الرئيسية لهذه التقنية في عملها كجسر يربط بين الخلية السرطانية والخلايا المناعية القاتلة، تحديداً الخلايا التائية (T-cells) أو الخلايا القاتلة الطبيعية (NK cells)؛ فبينما يرتبط أحد طرفي الجسم المضاد بمستضد محدد على سطح الخلية السرطانية (كـ CD19 أو CD20 الموجود على خلايا الليمفوما)، يرتبط الطرف الآخر بمستقبل تحفيزي (كـ CD3 على الخلايا التائية)؛ هذا الارتباط المزدوج يُقَرّب الخلايا المناعية من الخلية الخبيثة، ما يُحفز الجهاز المناعي على تدمير الخلية السرطانية مباشرةً بفعالية غير مسبوقة. وقد أثبتت هذه الآلية نجاحاً كبيراً في تعزيز الاستجابة ضد السرطان، مما يجعلها خياراً علاجياً قيّماً.
لقد توسّع النطاق السريري لاستخدام الأجسام المضادة ثنائية التخصص بشكل ملحوظ في علاج مجموعة من سرطانات الدم، خاصةً في الحالات التي انتكست أو أصبحت مقاومة للعلاجات التقليدية. ومن أبرز أنواع السرطانات التي تُعالج بهذه التقنية هي ابيضاض الدم الليمفاوي الحاد ذو الخلايا البائية (B-ALL)، وأنواع مختلفة من الليمفوما اللاهودجكينية (Non-Hodgkin Lymphoma)، بما في ذلك الليمفوما المنتشرة كبيرة الخلايا البائية (DLBCL)، والليمفوما الجريبية (Follicular Lymphoma)، إضافة إلى الورم النقوي المتعدد (Multiple Myeloma).
وتُقدم هذه الأجسام المضادة، وخاصة فئة “مُحفزات الخلايا التائية ثنائية التخصص (BiTEs)، ميزة هامة كونها علاجاً جاهزاً Off-the-shelf أي لا يتطلب عملية تصنيع فردية مُعقدة ومُطولة ما يقلل من القيود اللوجستية ويُسرّع بدء العلاج.
باختصار، تُمثل هذه العلاجات المبتكرة أحد أبرز التطورات في علم الأورام الدموية، حيث توجه ضربات مناعية عالية الدقة لتعزيز فرص الشفاء أو السيطرة على المرض. هذا التطور يمثل نقلة نوعية من مجرد قتل الخلايا إلى توظيف ذكي للجهاز المناعي لمعالجة المرض بأعراض جانبية يمكن التحكم بها بشكل أفضل من العلاج الكيميائي التقليدي.
العلاجات الموجهة
شكّلت العلاجات الموجهة، وتحديداً فئة مثبطات التيروزين كيناز (TKIs)، نقطة تحول حاسمة في التعامل مع سرطانات الدم المزمنة، خاصة ابيضاض الدم النخاعي المزمن (CML) المرتبط بـ كروموسوم فيلادلفيا (Ph).
لقد تطورت هذه المثبطات لتصل إلى أجيال حديثة تتمتع بكفاءة عالية في تجاوز مقاومة الأدوية التي كانت تحد من فاعلية الجيل الأول، بالإضافة إلى تقليل شدة الآثار الجانبية بشكل كبير. هذا التطور مكّن المرضى من العيش مع المرض لفترات طويلة مع السيطرة الكاملة عليه، وتحقيق استجابات عميقة تكاد تكون دائمة. واليوم، لم يعد الهدف هو مجرد التحكم في المرض، بل أصبح التركيز ينصب على إمكانية الإيقاف الآمن والمدروس للعلاج لدى المرضى الذين يصلون إلى استجابة جزيئية كاملة ومستدامة.
والأكثرمنذلك،يتمحالياًتوسيعاستخدامهذهالعلاجاتالموجهةلتشملمعالجةطيفأوسعمنالطفراتالجينيةفيأنواعأخرىمنالأورامالدموية،مايعكسفاعليتهاالاستراتيجيةفيالطبالشخصي. أما في ما يخص أنواع سرطانات الدم التي تعالجها مثبطات بروتون التيروزين كيناز، فإن العلاج المستهدف بهذه الفئة يتميز بفعالية استثنائية في حالات محددة تتواجد فيها الطفرة الجينية المستهدفة. يعد سرطان الدم النخاعي المزمن (Chronic Myeloid Leukemia – CML) هو المثال الأبرز والأكثر شيوعاً، حيث يمثل العلاج بـ TKIs (مثل الإيماتينيب، والداساتينيب، والنيلوتينيب) الخط الأول والقياسي للرعاية لهذا المرض، نظراً لاستهدافه الناجح لبروتين BCR-ABL.
بالإضافة إلى ذلك، تُستخدم أنواع أخرى من مثبطات التيروزين كيناز، مثل مثبطات بروتون التيروزين كيناز (BTK inhibitors)، في علاج:
- ابيضاض الدم الليمفاوي المزمن (Chronic Lymphocytic Leukemia – CLL).
- بعض أنواع الليمفوما اللاهودجكينية (Non-Hodgkin Lymphoma)، مثل الليمفوما ذات الخلايا البائية الصغيرة (Small Lymphocytic Lymphoma – SLL).
كما يمكن استخدام مثبطات التيروزين كيناز في بعض حالات ابيضاض الدم الليمفاوي الحاد (Acute Lymphoblastic Leukemia – ALL) التي تحمل طفرة كروموسوم فيلادلفيا، وغالباً ما تُستخدم في هذه الحالة بالاقتران مع العلاج الكيميائي. وبشكل عام، تعتمد فاعلية هذه العلاجات بشكل كبير على التحديد الدقيق للمستهدف الجزيئي في الخلية السرطانية لكل مريض.





